Istituto di Formazione Professionale in Ambito Scientifico
Tessuto adiposo: organo ad azione ormonale
Vi è una crescente evidenza sulla relazione che lega l’obesità a una vasta gamma di patologie invalidanti: diabete di tipo 2, epatosteatosi non legata al consumo di alcol, cancro, ipertensione, patologie cardiovascolari, patologie neurodegenerative (malattia di Alzheimer). Tutte queste condizioni patologiche contribuiscono alla crescente e sbalorditiva morbidità e mortalità associate all’obesità; l’osservazione dell’associazione tra obesità […]
Vi è una crescente evidenza sulla relazione che lega l’obesità a una vasta gamma di patologie invalidanti: diabete di tipo 2, epatosteatosi non legata al consumo di alcol, cancro, ipertensione, patologie cardiovascolari, patologie neurodegenerative (malattia di Alzheimer).
Tutte queste condizioni patologiche contribuiscono alla crescente e sbalorditiva morbidità e mortalità associate all’obesità; l’osservazione dell’associazione tra obesità e patologie cronico-metaboliche ha fatto emergere forti interessi verso la “biologia adipocitaria” e questi hanno culminato nel prendere coscienza che il tessuto adiposo è un importante organo endocrino (Cao, 2014; Naderali et al., 2009).
Infatti, il tessuto adiposo secerne una vasta gamma di molecole ad attività ormonale, le citochine, in grado di influenzare positivamente o negativamente il funzionamento degli altri principali organi.
Parte di ciò che verrà descritto in questo e nel prossimo capitolo rappresenta solo un saliente, conciso e breve “riassunto” dei fini e intricati processi proinfiammatori e antinfiammatori che si generano in risposta a un aumento del grasso viscerale e alla pratica di esercizio muscolare rispettivamente.
La sintesi di ciò che verrà esposto ha il solo scopo di far prendere coscienza:
- da un lato, le connessioni che si instaurano tra l’aumento del grasso viscerale e lo sviluppo delle malattie croniche, metaboliche e mortalità.
- dall’altro, quelle che legano esercizio fisico/aumento della massa muscolare al miglioramento della salute.
Sapere intervenire su questi fattori vuol dire essere in grado di impattare positivamente la salute e in modo totalmente naturale.
Genesi dell’Infiammazione Cronica Sistemica (da Tessuto Adiposo)
Con “infiammazione cronica sistemica” ci si riferisce a uno stato infiammatorio di lunga durata dove coesistono allo stesso momento:
- infiammazione attiva,
- degenerazione dei tessuti,
- e tentativi di riparazione.
L’infiammazione cronica sistemica di basso grado è data da un innalzamento del livello di citochine proinfiammatorie da 2 a 4 volte rispetto a condizioni basali non infiammatorie.
Sebbene tali livelli siano ben lontani da quelli osservati durante infezioni acute e severe, l’infiammazione sistemica di basso grado è fortemente associata all’invecchiamento e a fattori legati allo stile di vita: fumo, obesità, malnutrizione, insieme a un incrementato rischio per le patologie cardiovascolari, diabete di tipo 2, patologie neurodegenerative, cachessia.
Inoltre, l’infiammazione sistemica di basso grado è un forte e indipendente fattore predittivo di tutte le cause di morte e della mortalità nei soggetti anziani dovuta a patologie cardiovascolari (Pedersen et al., 2008).
Si vedrà come l’aumentare del tessuto adiposo addominale viscerale è una delle cause dell’infiammazione cronica di basso grado e altresì come la pratica costante di esercizio fisico eserciti un ruolo protettivo contro patologie cardiovascolari, diabete di tipo 2, cancro al colon, cancro al seno, malattia dell’Alzheimer (Fiuza-Luces et al., 2013; Pedersen et al., 2008; Chen et al., 2016).
’espansione del tessuto adiposo, soprattutto quello viscerale, crea ipossia cioè bassa presenza di ossigeno. La poca disponibilità di ossigeno porta alla morte dell’adipocita. Questo evento determina infiltrazione dei macrofagi all’interno del tessuto adiposo e da qui nasce il processo proinfiammatorio che si estende a tutti gli altri organi: cervello, pancreas, muscolo scheletrico, fegato compromettendone la loro funzionalità e predisponendo verso le patologie sopra riportate.
Biologia Adipocitaria
Questo paragrafo è molto tecnico, va nel profondo dei meccanismi molecolari e metabolici che si generano all’aumentare del tessuto adiposo e che creano infiammazione e compromissione della salute generale.
Lo troveranno interessante coloro che sono affamati di sapere.
Ho sempre pensato che la profonda conoscenza sia alla base della consapevolezza delle proprie scelte e del saper intervenire nel proprio stile di vita, e quanto sarà esposto fa comprendere la terribile complessità metabolica dell’essere obesi: una realtà che necessita di intervento attraverso educazione e informazione.
Per coloro che non lo trovassero interessante consiglio di passare al paragrafo successivo, poiché quanto seguirà è una rassegna minuziosa dei processi infiammatori che si instaurano all’aumentare delle dimensioni del tessuto adiposo viscerale.
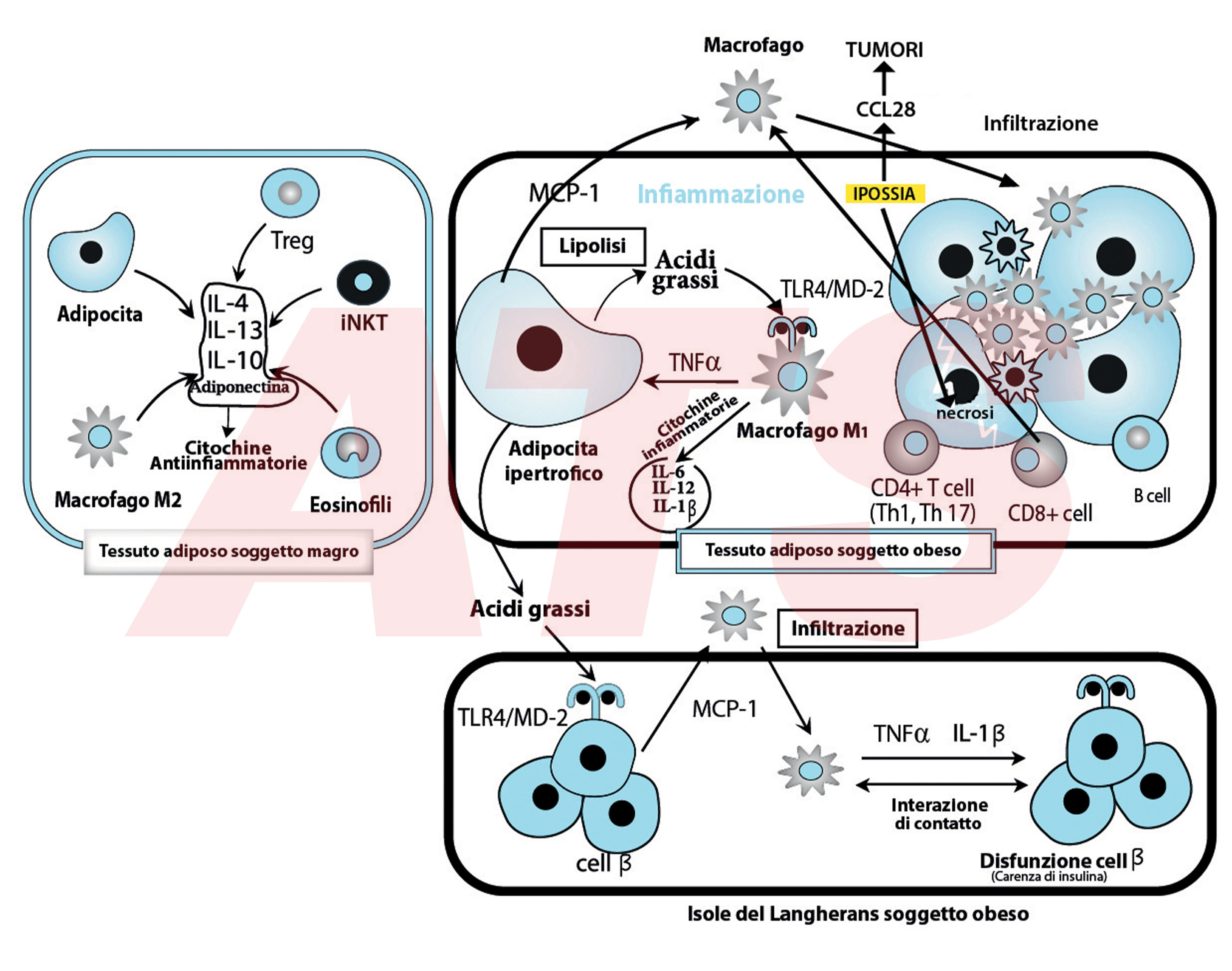
In figura sono riportati gli eventi molecolari che scatenano l’infiammazione in seguito all’aumento di dimensione del tessuto adiposo
In condizioni di non obesità il tessuto adiposo al suo interno risulta caratterizzato da adipociti di normali dimensioni (normotrofici).
Al suo interno, coesistono cellule del sistema immunitario: Treg, iNKT, Eosinofili, Macrofagi di tipo M2.
In condizioni di non obesità tali cellule secernono citochine ad attività antinfiammatoria: IL-4, IL-13, IL-10, Adiponectina (Watanabe et al., 2013).
Tale condizione “antinfiammatoria” viene compromessa quando il tessuto adiposo si espande e diventa obeso.
L’iniziazione del processo infiammatorio sarebbe relegata all’ipossia che si viene a creare durante l’espansione del tessuto adiposo e sarebbe dovuta a diversi fattori:
- all’aumentare del tessuto adiposo, masse di adipociti si allontanano sempre più dal tessuto vascolare (vasi sanguigni);
- nonostante l’aumento delle dimensioni del tessuto adiposo, la gettata cardiaca e il flusso sanguigno verso il tessuto adiposo non incrementano;
- gli adipociti di grandi dimensioni possono avere un diametro variabile dai 150 ai 200 μm (micrometri), risultando più espansi della normale distanza necessaria per la diffusione dell’ossigeno; tale distanza varia dai 100 ai 200 μm;
- diminuzione della densità capillare sia nei depositi adiposi viscerali che sottocutanei nota come rarefazione della vascolarizzazione.
N.B.: Interessante è sapere che in soggetti magri la densità capillare è maggiore nel tessuto adiposo viscerale rispetto a quello sottocutaneo, laddove negli obesi non vi è differenza di densità capillare tra i due compartimenti.
Questo vuol dire che nei soggetti magri non si verifica ipossia e, quindi, anche il processo infiammatorio a cascata non viene a crearsi (Trayhurn, 2013).
Ipossia
L’ipossia è la causa di molte disregolazioni metaboliche che compromettono fortemente l’equilibrio dell’organismo e la salute della persona. In condizioni di ipossia viene sovraregolata la chemochina CCL28; questa è la stessa che viene a crearsi in condizioni di ipossia nei tumori.
La CCL28 rappresenta uno dei fattori che legano l’obesità ai tumori dato che vi è un parallelismo tra espansione del tessuto adiposo viscerale e crescita tumorale; l’ipossia determina morte adipocitaria (necrosi) e questo evento fa scattare una serie di segnalazioni, tra cui l’accumulo di linfociti citotossici CD8+, che determinano infiltrazione dei macrofagi all’interno del tessuto adiposo (Watanabe et al., 2013; Ouchi et al., 2011; Trayhurn, 2013).
I macrofagi infiltrati che danno inizio ai processi infiammatori sono di tipo M1.
L’interazione degli acidi grassi, che si liberano dagli adipociti, con il recettore (TLR4-MD2) del macrofago M1 determina la secrezione di una serie di citochine proinfiammatorie: TNFα, IL-6, IL-1β, IL-12 (Watanabe et al., 2013).
N.B.: TNFα, IL-6, IL-1β, sono le stesse citochine che caratterizzano il quadro infiammatorio nell’artrite reumatoide.
Il TNFα, adipochina, rappresenta la prima citochina proinfiammatoria identificata nel tessuto adiposo che ha dato origine al concetto di “infiammazione metabolica”.
Rappresenta la connessione tra obesità e infiammazione e altresì costituisce un rischio che correla positivamente l’obesità allo sviluppo dei tumori; e tra tutte le conseguenze negative che fanno capo a essa vi è anche la perdita di massa muscolare (Cao, 2014; Lipina et al., 2017).
Ecco perché chi è grasso tende a essere più catabolico e quindi perdere massa muscolare.
L’interazione del TNFα con l’adipocita ipertrofico determina lipolisi con conseguente aumento della disponibilità di acidi grassi liberi.
In questo modo si ha una continua stimolazione dei recettori dei macrofagi M1 a cui segue ulteriore secrezione di citochine proinfiammatorie da parte dello stesso attivando un circolo vizioso proinfiammatorio.
L’interazione del TNFα con l’adipocita ipertrofico determina anche secrezione di una chemochina chiamata MCP-1.
L’MCP-1 determina ulteriore infiltrazione dei macrofagi nel tessuto adiposo supportando il circolo vizioso proinfiammatorio che, in tal modo, si autoalimenta e struttura. Inoltre, l’aumento delle dimensioni del tessuto adiposo fa deprimere i livelli di adiponectina, dei Treg e delle altre citochine antinfiammatorie: IL-10, IL-4, IL-13. Questo vuol dire predisporre l’organismo all’insulino resistenza e a tutte le altre patologie croniche che da essa derivano (Yu et al., 2017; Watanabe et al., 2013; Ouchi et al., 2011).
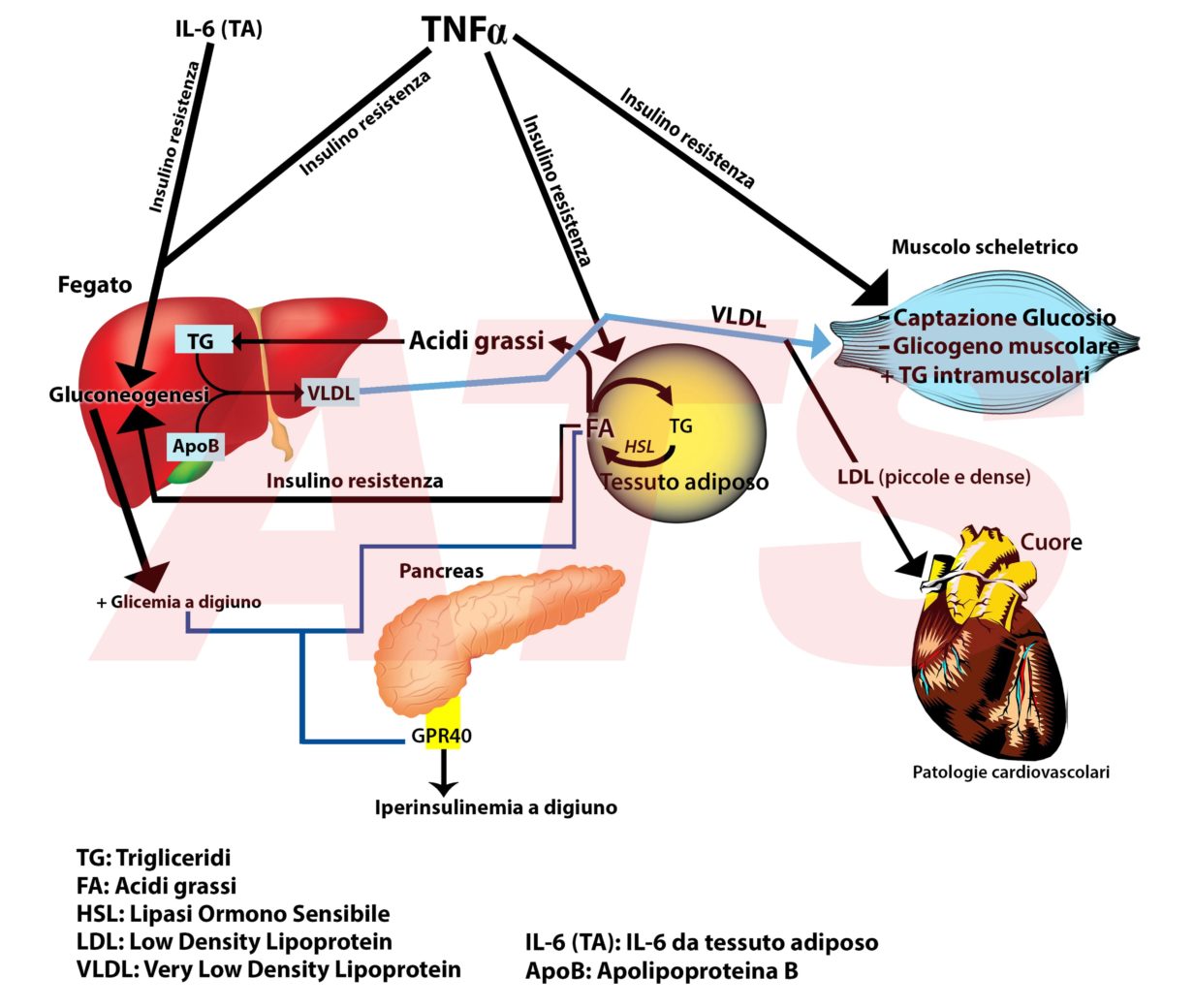
In figura sono rappresentate le alterazioni funzionali del tessuto adiposo, muscolo scheletrico, pancreas e fegato e le complicanze patologiche (cardiovascolari) dovute alle citochine infiammatorie (TNFα e IL-6) prodotte dall’eccesso di grasso viscerale
Il problema dell’infiammazione originatasi a livello del tessuto adiposo risiede nel fatto che questa produce effetti deleteri anche sul normale funzionamento degli altri organi.
Ecco perché il tessuto adiposo viscerale è anche un organo endocrino, ossia perché le citochine da esso prodotte hanno effetti anche a “distanza” su altri organi, e non solo su sé stesso. Il TNFα determina insulino resistenza su tessuto adiposo, fegato e sul muscolo scheletrico; l’IL-6, invece, sul fegato (Ouchi et al., 2011; Kelly et al., 2013).
Ecco alcune delle loro nefaste conseguenze a carico dei diversi organi: tessuto adiposo, fegato, muscolo scheletrico, pancreas.
Tessuto Adiposo
L’insulino resistenza sul tessuto adiposo determina un elevato rilascio di acidi grassi nel sangue. Questo evento determina anomalie nel funzionamento degli altri organi compromettendo la salute della persona e predisponendo verso lo sviluppo delle malattie croniche.
Vediamo come e perché.
L’insulino resistenza che si genera non permette all’insulina di inibire la lipolisi attivata dall’HSL. In tal modo il grasso viscerale del soggetto obeso è in continuo stato di lipolisi; questo vuol dire che nel tessuto adiposo vi è una costante scomposizione di trigliceridi in acidi grassi a cui segue un loro costante riversamento nel sangue.
L’adiponectina favorisce l’ossidazione dei grassi, ma in condizioni di obesità i suoi livelli sono depressi. Per tal motivo gli acidi grassi non possono essere utilizzati a scopo energetico e continuano a fluttuare nel sangue.
Ci si ritrova con una elevata quantità di acidi grassi liberi che crea danni su fegato, muscolo scheletrico e pancreas.
Fegato
Gli acidi grassi creano differenti alterazioni metaboliche:
- aumenta la formazione di trigliceridi e questo porta all’origine della steatosi epatica, nota anche come “fegato grasso” (Aguilera et al., 2008);
- determinano la formazione di ApoB100 portando alla secrezione di VLDL (Aguilera et al., 2008);
- insieme all’IL-6 determinano insulino resistenza (Ouchi et al, 2011; Kovacs et al., 2005);
- come conseguenza si attiva la gluconeogenesi che fa elevare la glicemia anche in assenza di apporto di carboidrati con la dieta (Wajchenberg, 2000).
N.B.: la gluconeogenesi è il processo per il quale il fegato produce zuccheri (glucosio) indipendentemente dall’apporto di zuccheri/carboidrati con la dieta. Questo vuol dire che il corpo produce glucosio anche in assenza di un suo apporto con gli alimenti.
Questa è la condizione che si crea in soggetti infiammati con elevato grasso viscerale. Tale evento spiega perché ci si ritrova ad avere la glicemia alta al mattino dopo tante ore di digiuno notturno e, quindi, ancora prima di avere consumato il primo pasto della giornata.
Muscolo Scheletrico
Il TNFα è il responsabile della resistenza all’insulina sul muscolo scheletrico attraverso diverse vie:
- altera gli IRS1 ed indirettamente distrugge IRS1 e IRS2; in tal modo l’azione dell’insulina risulta deficitaria e non riesce a regolarizzare la glicemia (Cao, 2014);
- determina la riduzione dei trasportatori di glucosio “GLUT4” (Pedersen et al., 2001).
La resistenza all’insulina e la sottoregolazione dei GLUT4 che occorrono in seguito ai processi infiammatori determinano una minor captazione di glucosio da parte delle fibre muscolari e conseguente minor formazione delle riserve energetiche glucidiche (glicogeno).
Questo vuol dire avere meno disponibilità energetica per impegni muscolari ad alta intensità.
N.B.: I GLUT 4 sono delle proteine che in presenza di stimoli quali: insulina, glucosio, contrazione muscolare, migrano dall’interno della cellula verso la membrana cellulare.
Il loro disporsi sulla membrana cellulare consente di captare il glucosio dal sangue e farlo entrare nella cellula.
In questo modo si riesce a:
- regolare la glicemia
- e ad aumentare i depositi energetici sotto forma di glicogeno muscolare.
In condizioni di infiammazione cronica questo processo risulta compromesso.
La conseguenza è che la glicemia rimane elevata. A ciò si aggiunge anche l’inibizione dell’enzima “esochinasi” (Thompson et al., 2000).
Ne consegue l’incapacità di utilizzare efficientemente il glucosio a scopo energetico.
La scarsa attività dell’esochinasi contribuisce a spiegare i bassi livelli energetici durante impegni muscolari intensi che richiedono energie di pronto utilizzo (glucosio) per la formazione di ATP da glicolisi anaerobica.
N.B.: il glucosio per poter essere usato a scopo energetico deve entrare nella glicolisi e l’esochinasi è l’enzima che consente al glucosio di entrarvi.
Invece, i processi infiammatori affievoliscono l’esochinasi e la capacità di utilizzare efficientemente glucosio è compromessa.
Le VLDL sintetizzate dal fegato svuotano il loro contenuto di trigliceridi a livello del tessuto muscolare facendo aumentare i trigliceridi intramuscolari; questi sono positivamente associati alle patologie cardiovascolari (Terry et al., 2017).
In seguito a ciò, le VLDL si trasformano in LDL piccole e dense altresì positivamente associate alle patologie cardiovascolari (Ouchi et al., 2011; Campo et al., 1992).
Vediamo come si traduce tutto questo per un soggetto sano che aumenta in modo abnorme il grasso viscerale con annessi processi infiammatori:
- aumento gluconeogenesi;
- alterazione substrati recettoriali all’insulina (IRS1);
- distruzione substrati recettoriali all’insulina (IRS1 e IRS2);
- diminuzione GLUT 4;
- scarsa attività dell’esochinasi;
- aumento dei lipidi intramuscolari;
- inibita ossidazione dei grassi intramuscolari;
- aumento delle LDL piccole e dense (frazioni aterogeniche in grado di depositarsi nelle pareti di grandi e medie arterie).
Un ampio spettro di fattori che non si presentano isolati, ma in contemporanea poiché seguono a una causa scatenante che è comune per ognuno di essi: processi proinfiammatori di basso grado originatisi da eccesso di grasso viscerale.
La combinazione di questi eventi fa entrare nella propria vita: diabetologo e cardiologo, e spiega il motivo di terapie farmacologiche per la regolazione della glicemia (esempio: metformina, insulina, etc.) e della colesterolemia (esempio: statine).
Pancreas
Gli acidi grassi rilasciati dal tessuto adiposo in seguito ai processi infiammatori interagiscono con un proteina recettoriale altamente espressa nel pancreas, la GPR40. L’interazione “acido grasso-GPR40” amplifica la stimolazione del glucosio sulla secrezione dell’insulina facendone aumentare i livelli nel sangue, condizione nota come iperinsulinemia (Itoh et al., 2003).
Questo vuol dire che se il glucosio da solo stimola la secrezione di insulina, la stessa quantità di glucosio quando accompagnata da un elevato livello di acidi grassi nel sangue ne determina una maggiore secrezione. L’iperinsulinemia determina accumulo di grasso nel tessuto adiposo; in pratica chi è grasso diventa più grasso.
Questa condizione per quanto già aberrante di per sé, non è ancora totalmente compromessa poiché in qualche modo il pancreas riesce ancora a produrre insulina. Ma se non si pone rimedio all’obesità, gli acidi grassi determinano peggiori conseguenze: entrano nel pancreas, reagiscono con le cellule beta pancreatiche (quelle che secernono insulina) determinando la secrezione di MCP-1, la stessa chemochina che nel tessuto adiposo alimenta il processo proinfiammatorio, inducendo il reclutamento di monociti dal sangue ai tessuti.
Ne consegue l’infiltrazione di macrofagi M1 anche nel pancreas e successiva secrezione di TNFα e IL-1β.
Il processo infiammatorio che si scatena porta alla morte delle cellule beta pancreatiche con conseguente riduzione della produzione di insulina.
In presenza di tale contingenza non si è più in grado di gestire gli zuccheri nel sangue, e il diabetologo e le terapie farmacologiche diventano certezze.
Perché arrivare a questo?
È possibile arrestare il nefasto circolo vizioso ancora prima che si inneschi. Tutto ciò può essere evitato con uno stile di vita salubre.
Altre problematiche legate all’ipossia si concretizzano nella non capacità del corpo di utilizzare a scopo energetico l’elevata disponibilità di acidi grassi liberati nel sangue dal tessuto adiposo.
L’espansione del tessuto adiposo (causa dell’ipossia) inibisce la secrezione di adiponectina; ne consegue una depressione di due enzimi coinvolti nell’ossidazione dei grassi: FATP-1 e AMPK (Aguilera et al., 2008).
Questo vuol dire che i soggetti in sovrappeso e obesi hanno grande capacità di “smantellare” i trigliceridi in acidi grassi e pressoché scarsa capacità di utilizzare gli acidi grassi a scopo energetico. Questo evento è responsabile, insieme ad altri, delle problematiche di disregolazione metabolica; non è la sola elevata disponibilità di grassi nel sangue a creare le alterazioni metaboliche su muscolo scheletrico, fegato e pancreas, ma anche la diminuita capacità di clearance degli stessi attraverso una loro inibita/inefficiente ossidazione.
Ma non finisce qua
L’inibita/inefficiente ossidazione degli acidi grassi non dipende solo dai bassi livelli di adiponectina; la chemochina CCL28 è responsabile della variazione del tipo di metabolismo del tessuto adiposo: da aerobico a anaerobico.
In virtù di ciò si ha una parallela sovraregolazione dei trasportatori di glucosio “GLUT1”.
Questo significa che il corpo diventa “avido” di zucchero prediligendolo come substrato energetico rispetto agli acidi grassi. Infatti, il tessuto adiposo obeso utilizza come via energetica il metabolismo anaerobico-lattacido e come conseguenza vi è grande produzione di acido lattico (Trayhurn, 2013).
Ciò vuol dire che il tessuto adiposo di un soggetto obeso consuma zuccheri e non acidi grassi.
La presenza di acido lattico potrebbe essere la soluzione alla spiccata lipolisi del tessuto adiposo mettendo un “freno” all’incremento della disponibilità di acidi grassi nel sangue; l’acido lattico è ritenuto il mediatore degli effetti antilipolitici dell’insulina, in altre parole l’insulina bloccherebbe la distruzione dei trigliceridi “anche” grazie alla presenza di acido lattico.
Ma l’effetto antilipolitico dell’insulina risulta inibito dallo stato ipossico che si crea a livello del tessuto adiposo obeso.
Questo vuol dire che in un soggetto obeso l’immissione in circolo di acidi grassi continua imperterrita e con essa il perpetuarsi di tutte le conseguenze negative che gli stessi arrecano sui principali organi del corpo.
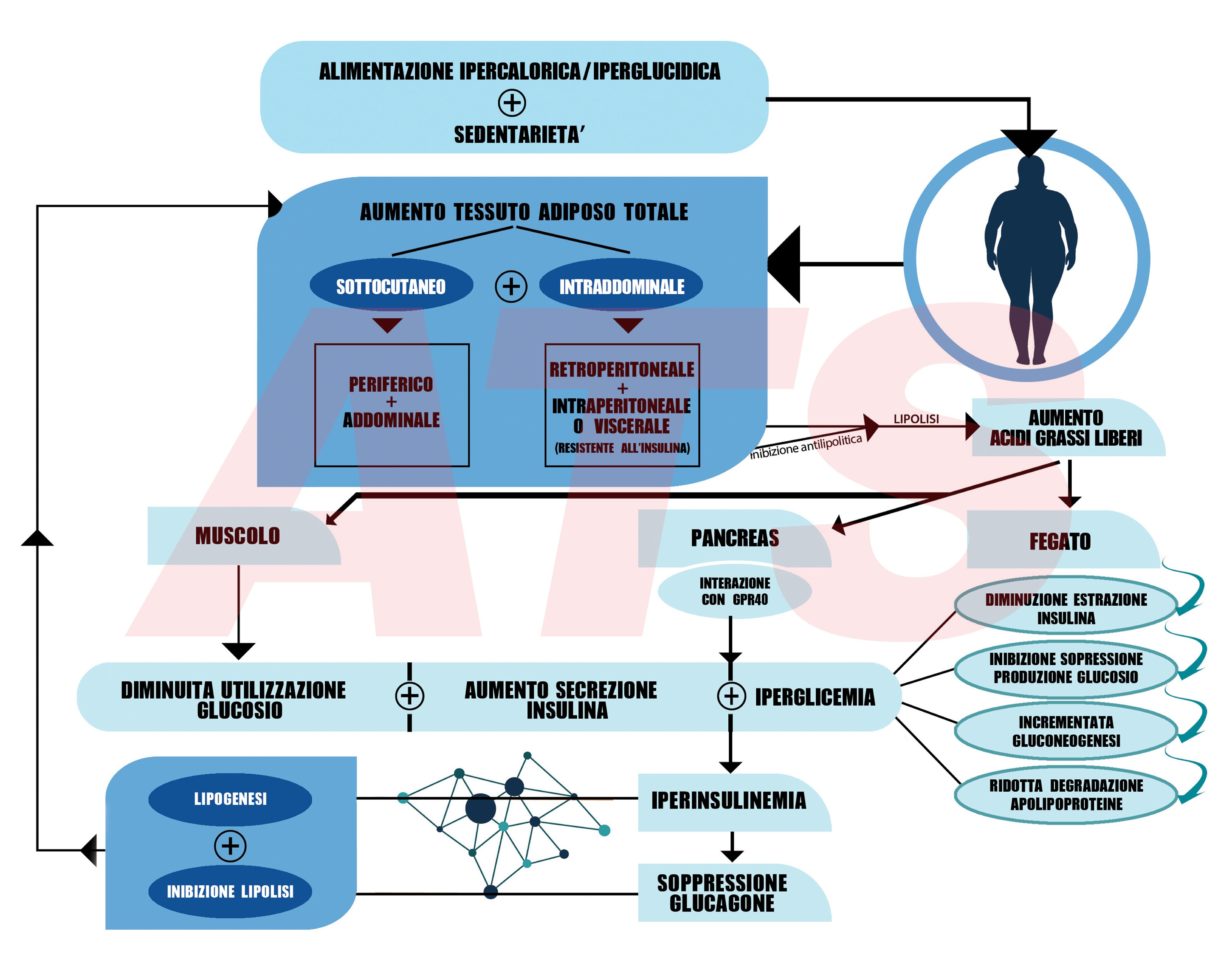
La sommatoria degli effetti esercitati dagli acidi grassi e dalle citochine proinfiammatorie sui diversi tessuti porta a condizioni di iperglicemia e, quindi, ad un quadro metabolico-ormonale alterato che predispone alla sindrome metabolica.
Inoltre, gli eventi evocati dall’elevata disponibilità di acidi grassi nel sangue innesca ed alimenta un circolo vizioso che può essere visto in duplice chiave:
- da un lato, gli stati iperglicemici e iperinsulinemici instaurati favoriscono ulteriore deposito di grasso;
- dall’altro, l’iperinsulinemia evocata è antitetica alla secrezione dell’ormone glucagone (ormone iperglicemizzante e lipolitico), ne consegue il blocco della lipolisi e dei processi di dimagrimento.
In pratica tali due eventi non solo favoriscono l’accumulo di ulteriore grasso, ma allo stesso tempo mettono dei lucchetti alle riserve di grasso impedendone un loro utilizzo.
Il sommarsi di lipogenesi (formazione dei trigliceridi) e antilipolisi (inibizione del catabolismo dei trigliceridi) favoriscono ulteriori incrementi quantitativi di tessuto adiposo. Si alimenta così un circolo vizioso tra grasso e processi infiammatori che compro- mette la salute della persona.
Per via dei motivi menzionati, nei soggetti in sovrappeso risulta spiccata la “De novo lipogenesi” e cioè la produzione di grassi da parte del fegato.
A parità di carboidrati introdotti in un pasto, i soggetti obesi producono più grassi dal fegato rispetto a soggetti magri.
Ma ciò che risulta più interessante è che nei soggetti obesi la “De novo lipogenesi” è elevata ancor prima di aver consumato il pasto; risulta positivamente associata ai livelli glicemici ed insulinemici presenti a digiuno ed alla massa grassa (Marques-Lopes et al., 2001).
In pratica si instaurano dei subdoli meccanismi che tendono a far rimanere grasso chi è già grasso.
Questa serie intrecciata di eventi catastrofici al mantenimento del corretto funzionamento organico, fa capire quanto “essere grassi” implichi l’essere forgiati da un quadro clinico patologico fortemente complesso, ma non del tutto compromesso, che per essere risolto, necessita di conoscenza e sapere e giammai di pressapochismo.
Il decremento del tessuto adiposo e l’aumento della massa muscolare, attraverso uno stile di vita sano (corretta alimentazione ed allenamento razionale), fanno venire meno le cause del quadro proinfiammatorio di basso grado e delle complicazioni organiche rappresentate nelle figure sottostanti.


Obesità Sarcopenica
Cos’è l’obesità sarcopenica e come si misura
Per obesità sarcopenica si intende la contemporanea coesistenza di obesità e poca massa muscolare/forza muscolare. Gli studi che hanno tentato di definire l’obesità sarcopenica hanno usato due parametri morfologico-antropometrici: massa muscolare scheletrica e superficie corporea (Stenholm et al., 2008).

In tabella sono riportati i valori antropometrici e di composizione corporea che classificano la sarcopenia e l’obesità secondo il NAHNES III e il New Mexico Aging Process Study. Rientrare in ambedue le classi definisce lo stato di obesità sarcopenica
Conseguenze dell’Obesità Sarcopenica
Se la perdita di massa muscolare e l’obesità considerati singolarmente condizionano negativamente lo stato di salute, avere poca massa muscolare ed essere obesi allo stesso tempo la compromette seriamente; infatti l’associazione di obesità e sarcopenia determina più disabilità e rischio cardiovascolare rispetto all’essere solo obesi o solo sarcopenici (Stenholm et al., 2008; Chung et al., 2013).
Nel cancro, sarcopenia e obesità sarcopenica, nella maggior parte dei casi, sono condizioni occulte che sono state associate in modo indipendente con l’alta incidenza della tossicità chemioterapica, a tempi più brevi nella progressione del tumore, esiti peggiori della chirurgia, debilitazione fisica e minor sopravvivenza (Prado et al., 2016). Sebbene obesità e sarcopenia possano presentarsi singolarmente e non necessariamente insieme, vi è una connessione causale che lega l’obesità alla sarcopenia (Stenholm et al., 2008).
Se sei grasso, perderai massa muscolare e diventerai ancora più grasso.
Questo articolo è tratto dal libro Nutrizione Funzionale

